Salud y Bienestar
AVANCE CIENTÍFICO| Crean riñones humanizados en embriones de cerdo durante 28 días
Publicado
hace 3 añosen
Un equipo científico del Instituto de Biomedicina y Salud de Guangzhou (China) ha logrado desarrollar embriones de cerdo, cuyos riñones contienen una combinación de células humanas y porcinas. El objetivo a largo plazo es mejorar esta tecnología para el trasplante de órganos humanos.
El estudio, que se publica hoy en la revista Cell Stem Cell, tiene como uno de sus autores principales al investigador español Miguel A. Esteban, experto en reprogramación celular porcina.
Esta es la primera vez que se consigue cultivar un órgano sólido humanizado dentro de otra especie. En estudios previos se habían utilizado métodos similares para generar tejidos humanos como sangre o músculo esquelético en cerdos.
Los investigadores decidieron centrarse en los riñones porque son uno de los primeros órganos en desarrollarse y también son los que más se trasplantan en medicina humana.

Nuestro método tiene como finalidad crear órganos humanos en cerdos con células de un paciente determinado. Esto evitaría los riesgos de rechazo inmunitario

Según comenta Esteban a SINC, él y su equipo llevan trabajando en este proyecto desde hace cinco años. A diferencia de los xenotransplantes, en los que se utilizan órganos de animales modificados genéticamente, este método “tiene como finalidad crear órganos humanos en cerdos con células de un paciente determinado. Esto evitaría los riesgos de rechazo inmunitario que, por ahora, sí tienen los xenotrasplantes”, subraya.
Hasta ahora, “se habían desarrollado órganos de ratones en ratonas, pero los intentos anteriores de cultivar órganos humanos en cerdos no tuvieron éxito», señala Liangxue Lai, líder del trabajo. “Nuestra técnica mejora la integración de células humanas en tejidos receptores y nos permite cultivar órganos humanos en cerdos”, destaca.
Los investigadores reconocen que la integración de células madre humanas en embriones de cerdo ha sido un gran reto “debido a que las células porcinas superan a las humanas y ambas tienen necesidades fisiológicas distintas”.
Un nicho dentro del embrión porcino
Para superarlo, el equipo creó primero un nicho dentro del embrión porcino para que las células humanas no tuvieran que competir con las del cerdo. “Utilizamos CRISPR Cas9 para manipular genéticamente el embrión unicelular de modo que le faltaran dos genes necesarios para el desarrollo renal”, explica Esteban.
Después, los autores modificaron células madre pluripotentes humanas —aquellas con potencial para convertirse en cualquier tipo de célula— para hacerlas más susceptibles de integración y menos propensas a la autodestrucción, desactivando temporalmente su apoptosis (muerte celular programada). A continuación, las convirtieron en células denominadas naive o ‘ingenuas’, que son parecidas a las primeras células embrionarias humanas, cultivándolas en un medio especial.
Implantaron 1.820 embriones en 13 cerdas. A los 25 o 28 días interrumpieron la gestación y comprobaron que algunos de ellos habían producido riñones humanizados
Posteriormente, antes de implantar los embriones en desarrollo en las cerdas, cultivaron las quimeras en condiciones mejoradas para proporcionar nutrientes y señales únicas tanto a las células humanas como a las porcinas, ya que ambos tipos suelen tener necesidades distintas.
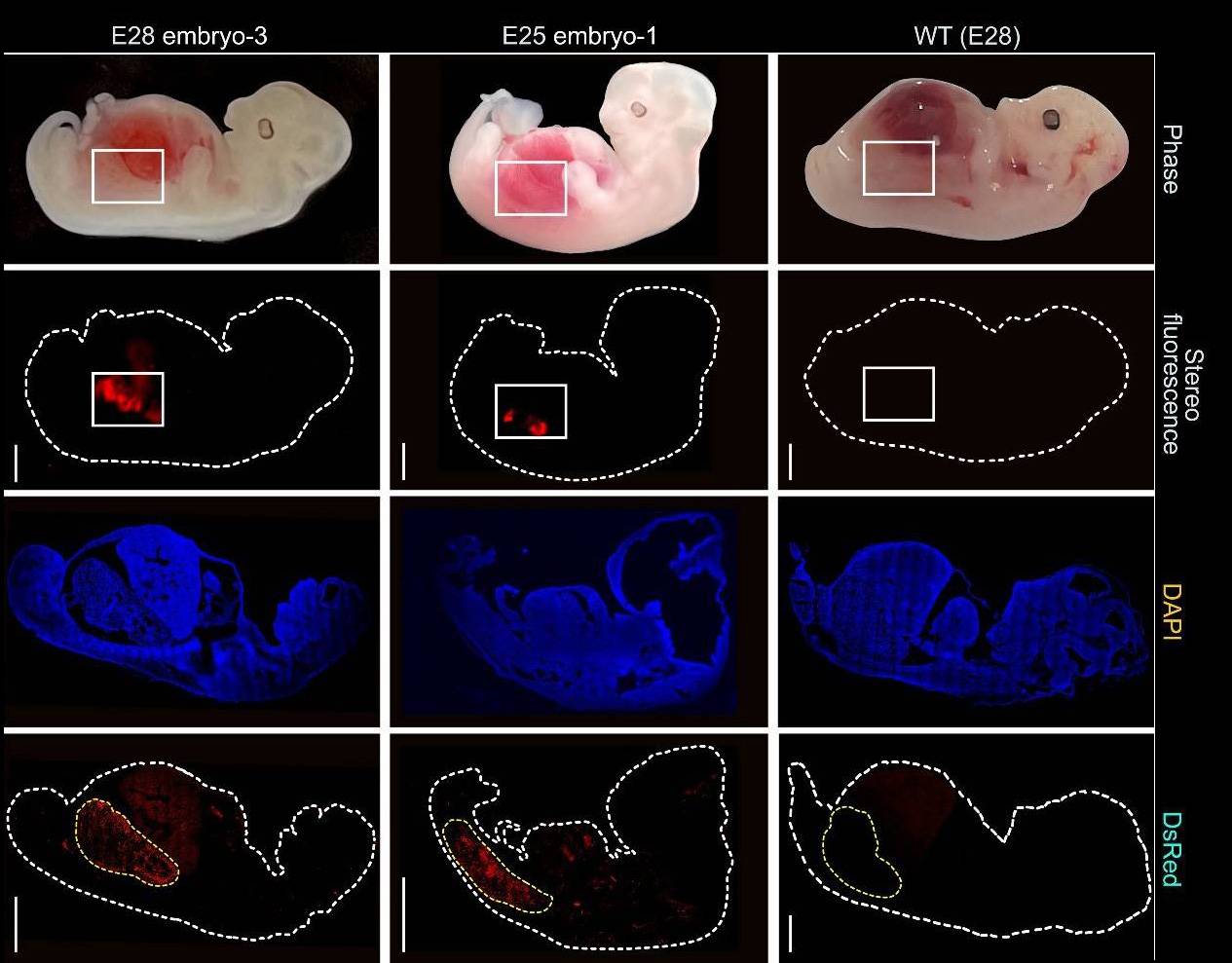
En total, se implantaron 1.820 embriones en 13 cerdas. A los 25 o 28 días, interrumpieron la gestación y extrajeron los embriones para evaluar si las quimeras habían logrado producir riñones humanizados.
Los científicos recogieron cinco embriones quiméricos para analizarlos —dos a los 25 días y tres a los 28 días de la implantación— y comprobaron que tenían riñones estructuralmente normales para su fase de desarrollo y estaban compuestos por entre un 50 % y un 60 % de células humanas.
A los 25-28 días, los riñones estaban en la fase de mesonefros (la segunda fase del desarrollo renal), habían formado túbulos y brotes de células que acabarían convirtiéndose en uréteres que conectaban el riñón con la vejiga.
A los 25-28 días, los riñones estaban en la fase de mesonefros (la segunda fase del desarrollo renal), habían formado túbulos y brotes de células que acabarían convirtiéndose en uréteres que conectaban el riñón con la vejiga
Implicaciones éticas
El equipo también investigó si las células humanas contribuían a otros tejidos de los embriones, lo que ocasionaría problemas desde el punto de vista ético. En este sentido, Esteban comenta que encontraron “muy pocas células humanas en otros tejidos y que estas se localizaron principalmente en los riñones”.
“Las implicaciones éticas podrían producirse, sobre todo, si las células fuesen muchas o estuvieran en linajes comprometidos como el neural y germinal, y, especialmente, si estos cerdos llegaran a nacer”, explica Esteban.
“De todos modos —añade— estamos siendo muy cautos y moviendo todo paso a paso para evitar sorpresas. Una de nuestras soluciones es modificar genéticamente las células humanas para que no puedan producir esos linajes comprometidos dentro del embrión de cerdo”, aclara.
Lo próximo: corazón y páncreas
Tras mejorar las condiciones para cultivar riñones humanizados en quimeras humano-cerdo, el equipo quiere ahora lograr que los riñones se desarrollen durante más tiempo. También está trabajando para generar otros órganos humanos en cerdos, como el corazón y el páncreas.
A la pregunta de en qué fase están estos otros proyectos, el investigador español comenta: “Aún no hemos prolongado la gestación de embriones de cerdo con riñón humano, estamos estudiando como hacerlo de manera eficiente y segura. Pero nuestros estudios para crear otros órganos humanos —en un estadio temprano del desarrollo embrionario— en embriones de cerdo están muy avanzados”.
A largo plazo, el objetivo es mejorar esta tecnología para el trasplante de órganos humanos, pero los investigadores reconocen que el trabajo será complejo y podría llevar muchos años.
“Como los órganos no están compuestos por un solo linaje celular, para tener un órgano en el que todo proceda del humano, probablemente tendríamos que diseñar los cerdos de una forma mucho más compleja y eso también conlleva algunos retos adicionales”, adelanta Esteban.

Nuestros estudios para crear otros órganos humanos —en un estadio temprano de desarrollo— en embriones de cerdo están muy avanzados

En concreto, agrega, “habría que hacer modificaciones de más genes en el cerdo, pero creo que es posible y tenemos una plataforma excepcional para la manipulación genética de estos animales”.
Mientras tanto, “nuestro método proporciona una ventana para estudiar el desarrollo humano”, señala Esteban, “por ejemplo, podemos rastrear las células humanas que inyectamos y manipularlas para poder estudiar enfermedades y cómo se forman los linajes celulares”.
El investigador español destaca que tanto él como sus colegas son conscientes de que “aún faltan años para que estos órganos estén disponibles en la práctica clínica y que habrá una serie de barreras moleculares que solucionar”. Sin embargo, “tras este primer avance importante, estamos ilusionados de los próximos pasos que puedan darse”.
Referencia:
Jiaowei Wang et al. «Generation of a Humanized Mesonephros in Pigs from Induced Pluripotent Stem Cells via Embryo Complementation». Cell Stem Cell, 2023.
Comparte esto:
- Haz clic para compartir en WhatsApp (Se abre en una ventana nueva)
- Haz clic para compartir en Facebook (Se abre en una ventana nueva)
- Haz clic para compartir en Twitter (Se abre en una ventana nueva)
- Haz clic para enviar un enlace por correo electrónico a un amigo (Se abre en una ventana nueva)
- Haz clic para compartir en Telegram (Se abre en una ventana nueva)
- Haz clic para compartir en LinkedIn (Se abre en una ventana nueva)
Relacionado
Te podría gustar
-


La Dra. Ana Cobo (IVI) aclara que la congelación de embriones durante la pandemia no ha afectado al éxito de los tratamientos
-


La inteligencia artificial en la selección embrionaria: una realidad gracias a IVI
-


IVI consigue tres premios científicos en el mayor congreso americano de reproducción asistida
Salud y Bienestar
Cinco bichos peligrosos que conviene evitar
Publicado
hace 7 díasen
4 marzo, 2026
Todos los bichos son molestos, pero los realmente peligrosos que podemos encontrar son aquellos capaces de transmitir enfermedades o que puedan invadir nuestra casa. Te damos 5 ejemplos de bichos a evitar:
Mosquito tigre (Aedes albopictus)
Es un mosquito pequeño, de color negro con pintas blancas y una raya blanca en cabeza y tórax. Prefiere picar durante el día y con más frecuencia en las piernas porque vuela próximo al suelo. Su peligrosidad radica en que es vector de enfermedades tropicales graves como el dengue y ahora agravado por el virus del zika. La solución es utilizar repelente durante el día.
Se ha extendido por todo el mediterráneo en los últimos años como consecuencia del transporte internacional de mercancías y ya es común en Cataluña, Levante, Baleares y Murcia, y menos en Andalucía.
Garrapata común (Ixodes ricinus)
Esta garrapata es distinta de la garrapata de los perros. Su peligro radica en que es vector de la enfermedad de Lyme. Aunque no es exactamente de ámbito doméstico, sí que está presente en el ámbito rural y no es tan difícil estar expuesto a ellas en los paseos por zonas de prados y bosques. De hecho, transmite la enfermedad al ser humano desde animales salvajes que actúan de reservorio de la misma.
La prevención consiste en revisarse bien el cuero cabelludo, axilas, las ingles, para buscar si llevamos alguna después de un paseo por el campo. Conviene vestir mangas y pantalón largo, y remeter el pantalón por dentro de los calcetines. La permetrina aplicada a la ropa actúa de repelente asimismo.
Chinche de las camas (Cimex lectularius)
No consta que el chinche transmita enfermedades y el principal problema que representan hoy en día la chinche es su resurgimiento en todo el mundo. Las infestaciones están en aumento en las grandes ciudades y pueden constituir un quebradero de cabeza difícil de erradicar porque ha desarrollado resistencia a insecticidas habituales.
Con una pequeña vaporeta se puede acceder a sus escondrijos y acabar con ellas. También,lavar la ropa a 60 ºC y usar secadora. En caso de necesitarlo, acudir a un profesional y asegurarse de que está inscrito en el Registro Oficial de Establecimientos y Servicios Biocidas de su comunidad autónoma.
Hormiga argentina (Linepithema humile)
El riesgo de estas hormigas muy pequeñas (aproximadamente 3 mm de longitud) y de color marrón radica en que se trata de una especie invasora capaz de instalarse en edificios y formar colonias gigantes de miles de nidos interconectados, ocupando cientos de kilómetros y acabando con otras hormigas como ha ocurrido en la franja costera mediterránea.
Por otra parte, también se ha observado a esta hormiga depredando sobre los nidos de procesionaria del pino, manteniendo zonas de pinares libres de la plaga de orugas. Las invasiones de las viviendas son más numerosas en los meses fríos de invierno con temperaturas bajas y humedad alta.
El único método efectivo de lucha contra la hormiga argentina es la prevención: evitar que haya comida accesible y zonas húmedas, se sienten muy atraídas por el azúcar. Nunca hay que rociar insecticida en los nidos porque lo que va a ocurrir es la dispersión de la colonia. En cambio, usar trampas con insecticida de efecto retardado sí es eficaz.
Araña reclusa parda mediterránea (Loxosceles rufescens)
Es característico su color castaño y un dibujo parecido a un violín que cubre el tórax. Su aparición es escasa y más propia de zonas cálidas, en especial el sur de la península, habiendo tenido repercusión algunos casos en Sevilla. No es una araña agresiva, al contrario busca rincones y lugares escondidos, lo que hace que a veces acabe en el interior de las viviendas, por lo que se conoce también como araña de rincón. Sin embargo, no es algo frecuente. Es más fácil encontrarla escondida pasando el inverno en arquetas de riesgo en el campo.
Su picadura es peligrosa, aunque no tanto como la famosa reclusa americana (Loxosceles reclusa). El peligro radica en que se puede necrosar la herida. Es raro que pique pero puede ocurrir que al meter la mano en despensas, baúles o cajones, si hay una que se ha escondido ahí y se siente atacada se defienda picándonos.
En caso de sufrir una picadura hay que intentar descubrir al culpable para que el tratamiento en urgencias sea rápido y el más adecuado. La picadura de una araña son dos puntitos donde ha clavado los quelíceros de la mandíbula. Acude a urgencias en cualquier caso ante una picadura de este tipo.
Favorecer la lucha biológica, el mejor insecticida
Recuerda que el mejor insecticida conocido son los pájaros insectívoros. Devoran anualmente toneladas de insectos de los que se alimentan y proporcionan a sus polluelos. A cambio de disponer de árboles donde poder anidar y un poco de tranquilidad, nos alegran el día con su canto.
No pienses que la solución a los bichos es usar más y más insecticida. Eso contamina el ambiente y daña a otros animales como pájaros, peces y abejas. Lo ideal es favorecer la lucha biológica para que se restablezca el equilibrio natural y, por nuestra parte, mantener a los bichos fuera de las viviendas.
Puedes seguir toda la actualidad visitando Official Press o en nuestras redes sociales: Facebook, Twitter o Instagram y también puedes suscribirte a nuestro canal de WhatsApp.
Comparte esto:
- Haz clic para compartir en WhatsApp (Se abre en una ventana nueva)
- Haz clic para compartir en Facebook (Se abre en una ventana nueva)
- Haz clic para compartir en Twitter (Se abre en una ventana nueva)
- Haz clic para enviar un enlace por correo electrónico a un amigo (Se abre en una ventana nueva)
- Haz clic para compartir en Telegram (Se abre en una ventana nueva)
- Haz clic para compartir en LinkedIn (Se abre en una ventana nueva)



Tienes que estar registrado para comentar Acceder